


БНБ
"БСЭ" (95279)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Магний
Определение "Магний" в Большой Советской Энциклопедии
Магний (лат. Magnesium), Mg, химический элемент II группы периодической системы Менделеева, атомный номер 12, атомная масса 24,305. Природный Магний состоит из трёх стабильных изотопов: 24Mg (78,60% ), 25Mg (10,11%) и 26Mg (11,29%). Магний открыт в 1808 Г. Дэви, который подверг электролизу с ртутным катодом увлажнённую магнезию (давно известное вещество); Дэви получил амальгаму, а из неё после отгонки ртути — новый порошкообразный металл, названный магнием. В 1828 французский химик А. Бюсси восстановлением расплавленного хлорида Магний парами калия получил Магний в виде небольших шариков с металлическим блеском.
Распространение в природе. Магний — характерный элемент мантии Земли, в ультраосновных породах его содержится 25,9% по массе. В земной коре Магний меньше, средний кларк его 1,87%; преобладает Магний в основных породах (4,5%), в гранитах и других кислых породах его меньше (0,56%). В магматических процессах Mg2+ — аналог Fe2+, что объясняется близостью их ионных радиусов (соответственно 0,74 и 0,80  ). Mg2+ вместе с Fe2+ входит в состав оливина, пироксенов и других магматических минералов.
). Mg2+ вместе с Fe2+ входит в состав оливина, пироксенов и других магматических минералов.
Минералы Магний многочисленны — силикаты, карбонаты, сульфаты, хлориды и другие (см. Магниевые руды). Более половины из них образовались в биосфере — на дне морей, озёр, в почвах и т. д.; остальные связаны с высокотемпературными процессами.
В биосфере наблюдается энергичная миграция и дифференциация Магний; здесь главная роль принадлежит физико-химическим процессам — растворению, осаждению солей, сорбции Магний глинами. Магний слабо задерживается в биологическом круговороте на континентах и с речным стоком поступает в океан. В морской воде в среднем 0,13% Магний — меньше, чем натрия, но больше всех других металлов. Морская вода не насыщена Магний и осаждения его солей не происходит. При испарении воды в морских лагунах в осадках вместе с солями калия накапливаются сульфаты и хлориды Магний В илах некоторых озёр накапливается доломит (например, в озере Балхаш). В промышленности Магний получают в основном из доломитов, а также из морской воды.
Физические и химические свойства. Компактный Магний — блестящий серебристо-белый металл, тускнеющий на воздухе вследствие образования на поверхности окисной плёнки. Магний кристаллизуется в гексагональной решётке, а = 3,2028 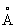 , с = 5,1998
, с = 5,1998  . Атомный радиус 1,60
. Атомный радиус 1,60  , ионный радиус Mg2+ 0,74
, ионный радиус Mg2+ 0,74 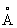 . Плотность Магний 1,739 г/см3 (20 °С); tпл 651 °С; tkип 1107 °С. Удельная теплоёмкость (при 20 °С) 1,04×103 дж/(кг·К), то есть 0,248 кал/(г·°С); теплопроводность (20 °С) 1,55×102 вт/(м·К), то есть 0,37 кал/(см·сек·°С); термический коэффициент линейного расширения в интервале 0—550 °С определяется из уравнения 25,0×10-6 + 0,0188 t. Удельное электрическое сопротивление (20 °С) 4,5×10-8 ом·м (4,5 мком·см). Магний парамагнитен, удельная магнитная восприимчивость + 0,5×10-6, Магний — относительно мягкий и пластичный металл; его механические свойства сильно зависят от способа обработки. Например, при 20 °С свойства соответственно литого и деформированного Магний характеризуются следующими величинами: твёрдость по Бринеллю 29,43×107 и 35,32× 107 н/м2 (30 и 36 кгс/мм2), предел текучести 2,45×107 и 8,83×107 н/м7 (2,5 и 9,0 кгс/мм2), предел прочности 11,28×107 и 19,62×107н/м2 (11,5 и 20,0 кгс/мм2), относительное удлинение 8,0 и 11,5%.
. Плотность Магний 1,739 г/см3 (20 °С); tпл 651 °С; tkип 1107 °С. Удельная теплоёмкость (при 20 °С) 1,04×103 дж/(кг·К), то есть 0,248 кал/(г·°С); теплопроводность (20 °С) 1,55×102 вт/(м·К), то есть 0,37 кал/(см·сек·°С); термический коэффициент линейного расширения в интервале 0—550 °С определяется из уравнения 25,0×10-6 + 0,0188 t. Удельное электрическое сопротивление (20 °С) 4,5×10-8 ом·м (4,5 мком·см). Магний парамагнитен, удельная магнитная восприимчивость + 0,5×10-6, Магний — относительно мягкий и пластичный металл; его механические свойства сильно зависят от способа обработки. Например, при 20 °С свойства соответственно литого и деформированного Магний характеризуются следующими величинами: твёрдость по Бринеллю 29,43×107 и 35,32× 107 н/м2 (30 и 36 кгс/мм2), предел текучести 2,45×107 и 8,83×107 н/м7 (2,5 и 9,0 кгс/мм2), предел прочности 11,28×107 и 19,62×107н/м2 (11,5 и 20,0 кгс/мм2), относительное удлинение 8,0 и 11,5%.
Конфигурация внешних электронов атома Магний 3s2. Во всех стабильных соединениях Магний двухвалентен. В химияеском отношении Магний — весьма активный металл. Нагревание до 300—350 °C не приводит к значительному окислению компактного Магний, так как поверхность его защищена окисной плёнкой, но при 600—650 °C Магний воспламеняется и ярко горит, давая магния окись и отчасти нитрид Mg3N2. Последний получается и при нагревании Магний около 500 °С в атмосфере азота. С холодной водой, не насыщенной воздухом, Магний почти не реагирует, из кипящей медленно вытесняет водород; реакция с водяным паром начинается при 400 °C. Расплавленный Магний во влажной атмосфере, выделяя из H2O водород, поглощает его; при застывании металла водород почти полностью удаляется. В атмосфере водорода Магний при 400—500 °C образует MgH3.
Магний вытесняет большинство металлов из водных растворов их солей; стандартный электродный потенциал Mg при 25 °С — 2,38 в. С разбавленными минеральными кислотами Магний взаимодействует на холоду, но в плавиковой кислоте не растворяется вследствие образования защитной плёнки из нерастворимого фторида MgF2. В концентрированной H2SO4 и смеси её с HNO3 Магний практически нерастворим. С водными растворами щелочей на холоду Магний не взаимодействует, но растворяется в растворах гидрокарбонатов щелочных металлов и солей аммония. Едкие щёлочи осаждают из растворов солей Магний гидроокись Mg(OH)2, растворимость которой в воде ничтожна. Большинство солей Магний хорошо растворимо в воде, например магния сульфат; мало растворимы MgF2, MgCO3 (см. Магния карбонат), Mg3(PO4)2 и некоторые двойные соли.
При нагревании Магний реагирует с галогенами, давая галогениды; с влажным хлором уже на холоду образуется MgCl2. При нагревании Магний до 500—600 °С с серой или с SO2 и H2S может быть получен сульфид MgS, с углеводородами — карбиды MgC2 и Mg2C3. Известны также силициды Mg2Si, Mg3Si2, фосфид Mg3P2 и другие бинарные соединения. Магний — сильный восстановитель; при нагревании вытесняет другие металлы (Be, Al, щелочные) и неметаллы (В, Si, С) из их окислов и галогенидов. Магний образует многочисленные металлоорганические соединения, определяющие его большую роль в органическом синтезе (см. Магнийорганические соединения). Магний сплавляется с большинством металлов и является основой многих технически важных лёгких сплавов.
Получение и применение. В промышленности наибольшее количество Магний получают электролизом безводного хлорида MgCl2 или обезвоженного карналлита KCl×MgCl2×6H2O (см. Магния хлорид). В состав электролита входят также хлориды Na, К, Са и небольшое количество NaF или CaF2. Содержание MgCl2 в расплаве — не менее 5—7%; по мере хода электролиза, протекающего при 720—750 °С, проводят корректировку состава ванны, удаляя часть электролита и добавляя MgCl2 или карналлит. Катоды изготовляют из стали, аноды — из графита. Расплавленный Магний, всплывающий на поверхность электролита, периодически извлекается из катодного пространства, отделённого от анодного перегородкой, не доходящей до дна ванны. В состав чернового Магний входят до 2% примесей; его рафинируют в тигельных электрических печах под слоем флюсов и разливают в изложницы. Лучшие сорта первичного Магний содержат 99,8% Mg. Последующая очистка Магний проводится сублимацией в вакууме: 2—3 сублимации повышают чистоту Магний до 99,999%. Анодный хлор после очистки используется для получения безводного MgCl2 из магнезита, тетрахлорида титана TiCl4 из двухокиси TiO2 и других соединений.
Другие способы получения Магний — металлотермический и углетермический. По первому брикеты из прокалённого до полного разложения доломита и восстановителя (ферросилиция или силикоалюминия) нагревают при 1280—1300 °С в вакууме (остаточное давление 130—260 н/м2, то есть 1—2 мм рт. ст.). Пары Магний конденсируют при 400—500 °С. Для очистки его переплавляют под флюсом или в вакууме, после чего разливают в изложницы. По углетермическому способу брикеты из смеси угля с окисью Магний нагревают в электропечах выше 2100 °С; пары Магний отгоняют и конденсируют.
Важнейшая область применения металлического Магний — производство сплавов на его основе (см. Магниевые сплавы). Широко применяют Магний в металлотермических процессах получения трудновосстанавливаемых и редких металлов (Ti, Zr, Hf, U и других), используют Магний для раскисления и десульфурации металлов и сплавов. Смеси порошка Магний с окислителями служат как осветительные и зажигательные составы. Широкое применение находят соединения Магний
Лит.: Стрелец Х. Л., Тайц А. Ю., Гуляницкий Б. С., Металлургия магния, 2 изд., Магний, 1960; Ulbmann Encykiopädie der technischen Chemie, 3 Aufl., Bd 12, Münch. — В., 1960.
В. Е. Плющев.
Магний в организме. Магний — постоянная часть растительных и животных организмов (в тысячных — сотых долях процента). Концентраторами Магний являются некоторые водоросли, накапливающие до 3% Магний (в золе), некоторые фораминиферы — до 3,5%, известковые губки — до 4%. Магний входит в состав зелёного пигмента растений — хлорофилла (в общей массе хлорофилла растений Земли содержится около 100 млрд. т Магний), а также обнаружен во всех клеточных органеллах растений и рибосомах всех живых организмов. Магний активирует многие ферменты, вместе с кальцием и марганцем обеспечивает стабильность структуры хромосом и коллоидных систем в растениях, участвует в поддержании тургорного давления в клетках. Магний стимулирует поступление фосфора из почвы и его усвоение растениями, в виде соли фосфорной кислоты входит в состав фитина. Недостаток Магний в почвах вызывает у растений мраморность листа, хлороз растений (в подобных случаях используют магниевые удобрения). Животные и человек получают Магний с пищей. Суточная потребность человека в Магний — 0,3—0,5 г; в детском возрасте, а также при беременности и лактации эта потребность выше. Нормальное содержание Магний в крови — примерно 4,3 мг%; при повышенном содержании наблюдаются сонливость, потеря чувствительности, иногда паралич скелетных мышц. В организме Магний накапливается в печени, затем значительная его часть переходит в кости и мышцы. В мышцах Магний участвует в активировании процессов анаэробного обмена углеводов. Антагонистом Магний в организме является кальций. Нарушение магниево- href="http://Ca-Calcium.info/">кальциевого равновесия наблюдается при рахите, когда Магний из крови переходит в кости, вытесняя из них кальций. Недостаток в пище солей Магний нарушает нормальную возбудимость нервной системы, сокращение мышц. Крупный рогатый скот при недостатке Магний в кормах заболевает так называемой травяной тетанией (мышечные подёргивания, остановка роста конечностей). Обмен Магний у животных регулируется гормоном паращитовидных желёз, понижающим содержание Магний в крови, и проланом, повышающим содержание Магний Из препаратов Магний в медицинской практике применяют: сульфат Магний (как успокаивающее, противосудорожное, спазмолитическое, слабительное и желчегонное средство), магнезию жжёную (магния окись) и карбонат Магний (как щёлочи, лёгкое слабительное).
Г. Я. Жизневская.
| "БСЭ" >> "М" >> "МА" >> "МАГ" >> "МАГН" |
Статья про "Магний" в Большой Советской Энциклопедии была прочитана 531 раз
| Пицца в сковороде |
| Бургер двойного помола |
TOP 20
- Лемке Михаил Константинович
- Сульфгидрильные группы
- «Казарменный коммунизм»
- Глициния
- Японское море
- Периодическая система элементов
- Башкирская Автономная Советская Социалистическая Республика
- Иммунитет (историч.)
- Андаманское море
- Сенсуализм
- «Сообразительный»
- Звёздная астрономия
- Балкано-кавказская раса
- Ямполь (пос. гор. типа в Донецкой обл.)
- Навигация (морск.)
- Кульчицкая Елена Львовна
- Мандельштама - Бриллюэна рассеяние
- Театральные учебные заведения
- Электрическая постоянная
- Энсор Джеймс