


БНБ
"БСЭ" (95279)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Произведение растворимости
Определение "Произведение растворимости" в Большой Советской Энциклопедии
Произведение растворимости, произведение концентраций ионов в насыщенном растворе малорастворимого сильного электролита. Показатели степени для концентраций, входящих в Произведение растворимости, равны коэффициенту при соответствующем ионе в уравнении диссоциации электролита. Для неидеальных растворов концентрации должны быть заменены на активности и полученное произведение называется произведением активностей. При данной температуре и в данном растворителе Произведение растворимости для каждого электролита есть характерная постоянная величина.
Постоянство Произведение растворимости выводится из действующих масс закона и представляет собой частную форму этого закона в приложении к равновесию твёрдый электролит Û его насыщенный раствор. При этом предполагается, что в растворе электролит находится в полностью диссоциированной форме. Произведение растворимости наиболее точно измеряется методом эдс. Часто для измерения Произведение растворимости используют также определение растворимости по электропроводности насыщенных растворов. Для многих соединений Произведение растворимости установлено с достаточной для практических целей точностью. В таблицах Произведение растворимости обычно приводятся при температуре 25 °С (иногда при 18 °С).
Из правила постоянства Произведение растворимости следует, что если произведение концентраций ионов в растворе превышает величину Произведение растворимости, то выпадает осадок; в противном случае осадок не образуется. Это следствие позволяет регулировать содержание ионов в растворе при использовании процессов осаждения, растворения, а также высаливания, имеющих большое значение в аналитической химии и химической технологии. Так, при увеличении концентрации одного из ионов путём введения в раствор нового электролита с одноимённым катионом или анионом концентрация др. иона понижается за счёт выпадения части труднорастворимого электролита в осадок. Понижение растворимости происходит обычно лишь до некоторого минимального значения, после чего может наблюдаться вновь повышение растворимости из-за образования комплексных ионов или увеличения ионной силы раствора. Повышения растворимости можно достигнуть, связывая один из ионов в растворе, так что образуется др. ион, который не даёт малорастворимого соединения. Например, для перевода в раствор осадка СаСО3 ион  связывают с помощью иона Н+ в слабо диссоциированный ион
связывают с помощью иона Н+ в слабо диссоциированный ион 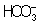 :
: 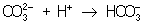 ; концентрация ионов
; концентрация ионов  при этом уменьшается и осадок растворяется до тех пор, пока не будет достигнуто Произведение растворимости
при этом уменьшается и осадок растворяется до тех пор, пока не будет достигнуто Произведение растворимости
Лит.: Справочник химика, 2 изд., т. 3, М. - Л., 1965; Курс физической химии, под ред. Я. И. Герасимова, 2 изд., т. 2, М., 1973, гл. 18.
Н. Ф. Степанов.
| "БСЭ" >> "П" >> "ПР" >> "ПРО" >> "ПРОИ" |
Статья про "Произведение растворимости" в Большой Советской Энциклопедии была прочитана 508 раз
| Коптим скумбрию в коробке |
| Луковый соус |
TOP 20
- Лемке Михаил Константинович
- Сульфгидрильные группы
- «Казарменный коммунизм»
- Глициния
- Японское море
- Периодическая система элементов
- Башкирская Автономная Советская Социалистическая Республика
- Иммунитет (историч.)
- Андаманское море
- Сенсуализм
- «Сообразительный»
- Звёздная астрономия
- Балкано-кавказская раса
- Ямполь (пос. гор. типа в Донецкой обл.)
- Навигация (морск.)
- Кульчицкая Елена Львовна
- Мандельштама - Бриллюэна рассеяние
- Театральные учебные заведения
- Электрическая постоянная
- Энсор Джеймс