


БНБ
"БСЭ" (95279)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Тройная связь
Определение "Тройная связь" в Большой Советской Энциклопедии
Тройная связь, химическая ковалентная связь, осуществляемая тремя парами электронов, находящихся в поле двух атомных ядер. Тройная связь включает одну s- и две p-связи (см. Сигма- и пи-связи); результирующее распределение электронной плотности между двумя связанными ядрами имеет осевую симметрию (как в случае простой связи). В структурных формулах химических соединений Тройная связь между атомами обозначается тремя валентными штрихами, например N º N, С º С, C º N. Если одна или обе p-компоненты Тройная связь (например, между атомами А и В) образуются в результате донорно-акцепторного взаимодействия (см. Донорно-акцепторная связь), такие Тройная связь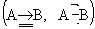
обычно называют квазитройными (в «нормальной» Тройная связь А º В s и две p-компоненты образованы в результате взаимодействия неспаренных электронов). Примеры квазитройных связей: связь концевого атома кислорода с атомом переходного металла (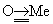 , так называемая «иловая» связь), например в K2[ReOCI5], связь в молекуле
, так называемая «иловая» связь), например в K2[ReOCI5], связь в молекуле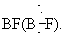
Вследствие большой энергии Тройная связь и квазитройных связей соответствующие молекулы (например, N2, CO) или молекулярные фрагменты (например, N º Me, 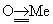 ) термодинамически устойчивы и обычно химически инертны. Так, фиксация молекулярного азота (то есть активация его для химических превращений) невозможна без предварительной координации его как лиганда в определённых комплексах переходных металлов, в результате которой кратность (прочность) связи азот - азот существенно уменьшается.
) термодинамически устойчивы и обычно химически инертны. Так, фиксация молекулярного азота (то есть активация его для химических превращений) невозможна без предварительной координации его как лиганда в определённых комплексах переходных металлов, в результате которой кратность (прочность) связи азот - азот существенно уменьшается.
Если раньше в основном изучались Тройная связь между лёгкими атомами (С, N), то теперь всё большее внимание уделяется Тройная связь с участием тяжёлых атомов, прежде всего атомов переходных металлов; эти тройные связи реализуются в новых типах комплексных соединений. Уже изучено большое число комплексных соединений переходных металлов с нитридо (N º )–, оксо 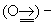 , имино
, имино 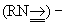 и карбиновыми (RC º ) группами как лигандами, характеризующимися высокой прочностью химических связей. Важной особенностью указанных лигандов является их сильное трансвлияние (то есть сильное ослабление связи металл - лиганд в транспозиции), что предопределяет многие свойства и реакционную способность таких соединений. Кроме того, известны димерные кластеры переходных металлов с Тройная связь металл - металл, например Mo2[N (CH3)2]6. Эта молекула имеет центросимметричную повёрнутую (как в этане C2H6) конфигурацию, что обусловлено осевой симметрией распределения электронной плотности в связи Me º Me, где Me - металл. См. также Валентность, Химическая связь.
и карбиновыми (RC º ) группами как лигандами, характеризующимися высокой прочностью химических связей. Важной особенностью указанных лигандов является их сильное трансвлияние (то есть сильное ослабление связи металл - лиганд в транспозиции), что предопределяет многие свойства и реакционную способность таких соединений. Кроме того, известны димерные кластеры переходных металлов с Тройная связь металл - металл, например Mo2[N (CH3)2]6. Эта молекула имеет центросимметричную повёрнутую (как в этане C2H6) конфигурацию, что обусловлено осевой симметрией распределения электронной плотности в связи Me º Me, где Me - металл. См. также Валентность, Химическая связь.
Лит.: Шусторович Е. М., Химическая связь, М., 1973.
Е. М. Шусторович.
| "БСЭ" >> "Т" >> "ТР" >> "ТРО" >> "ТРОЙ" |
Статья про "Тройная связь" в Большой Советской Энциклопедии была прочитана 545 раз
| Пицца в сковороде |
| Салат тофу |
TOP 20
- Лемке Михаил Константинович
- Сульфгидрильные группы
- «Казарменный коммунизм»
- Глициния
- Японское море
- Периодическая система элементов
- Башкирская Автономная Советская Социалистическая Республика
- Иммунитет (историч.)
- Андаманское море
- Сенсуализм
- «Сообразительный»
- Звёздная астрономия
- Балкано-кавказская раса
- Ямполь (пос. гор. типа в Донецкой обл.)
- Навигация (морск.)
- Кульчицкая Елена Львовна
- Мандельштама - Бриллюэна рассеяние
- Театральные учебные заведения
- Электрическая постоянная
- Энсор Джеймс