


БНБ
"БСЭ" (95279)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Тройные системы
Определение "Тройные системы" в Большой Советской Энциклопедии
 |
| Тройные системы. Рис. |
 |
| Тройные системы. Рис. |
 |
| Тройные системы. Рис. |
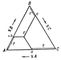
В точке Е число сосуществующих фаз, максимальное для Тройные системы, равно 4 (жидкость и кристаллы А, В, С), а их равновесие нонвариантно (температура кристаллизации и состав фаз постоянны).
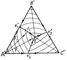
Пользоваться объёмным изображением диаграмм состояния Тройные системы практически очень неудобно, поэтому применяют ортогональные проекции и сечения: горизонтальные - изотермические и вертикальные - политермические (см. Физико-химический анализ). На рис. 3 показана проекция диаграммы рис. 2 на плоскость треугольника A"B"C". На ней 3 поверхности ликвидуса изображаются 3 полями кристаллизации A"e"1E"e"3, B"e"1E"e"2 C"e"2E"e"3, проекция солидуса, очевидно, совпадает с треугольником A"B"C". Стрелки указывают направления понижения температур. Рассмотрим последовательность выделения твёрдых фаз в поле A"e"1E"e"3. Если точка F лежит на прямой A"E", то из жидкой фазы при охлаждении выпадают кристаллы А, причём отношение концентраций В и С остаётся постоянным. В результате, когда состав Тройные системы достигнет точки E", начинается совместная кристаллизация компонентов А, В и С при постоянной температуре (так как при 4 фазах и постоянном давлении Тройные системы нонвариантна). Если точка F1 лежит в области A"e"1E"; то сначала выпадают кристаллы А, затем, когда состав жидкой фазы дойдёт до точки f1, по кривой e1E" пойдёт совместная кристаллизация А и В, затвердевание закончится в точке E". Итак, последовательность кристаллизации жидкой фазы состава F1 изображается в совокупности отрезком F1f1E". Подобным же образом можно проследить ход кристаллизации любой жидкой фазы системы А - В - С. На той же проекции наносят изотермы начала кристаллизации (показаны тонкими линиями). Вертикальные сечения более сложны, чем диаграммы двойных систем. Исключение составляют так называемые квазибинарные сечения тех Тройные системы, где образуются двойные и тройные соединения постоянного состава. Правила проведения таких сечений (сингулярная триангуляция Тройные системы), впервые сформулированные в 1925 Н. С. Курнаковым, позволяют упростить рассмотрение сложных Тройные системы
Экспериментальное построение полных диаграмм состояния Тройные системы очень трудоёмко. Между тем для практических целей нередко достаточно построения боковых двойных систем и положения моновариантных кривых, нонвариантных точек и областей распространения твёрдых растворов на основе компонентов Тройные системы В ряде случаев термодинамические расчёты простейших типов двойных и тройных диаграмм состояния дают результаты, близкие к экспериментальным данным. Для расчётов равновесий в Тройные системы используют различные упрощённые модели; для решения сложных термодинамических уравнений разработаны специальные программы и применяется вычислительная техника.
Лит.: Курнаков Н. С., Избр. труды, т.1-3, М., 1960-63; Аносов В. Я., Погодин С. А., Основные начала физико-химического анализа, М. - Л., 1947; Воловик Б. Е., Захаров М. В., Тройные и четверные системы, М., 1948; Петров Д. А., Тройные системы, М., 1953; Справочник по плавкости систем из безводных неорганических солей, т. 1-2, М, - Л., 1961; Захаров А. М., Диаграммы состояний двойных и тройных систем, М., 1964; Ванюков А. В., Зайцев В. Я., Шлаки и штейны цветной металлургии, М., 1969; Крестовников А. Н., Вигдорович В. Н., Химическая термодинамика, 2 изд., М., 1973; Кауфман Л., Бернстейн Х., Расчет диаграмм состояния с помощью ЭВМ, пер. с англ., М., 1972; Диаграммы состояния металлических систем, в. 1-18, М., 1959-75.
| "БСЭ" >> "Т" >> "ТР" >> "ТРО" >> "ТРОЙ" |
Статья про "Тройные системы" в Большой Советской Энциклопедии была прочитана 843 раз
| Бургер двойного помола |
| Вкуснейшие куриные леденцы |
TOP 20
- Лемке Михаил Константинович
- Сульфгидрильные группы
- «Казарменный коммунизм»
- Глициния
- Японское море
- Периодическая система элементов
- Башкирская Автономная Советская Социалистическая Республика
- Иммунитет (историч.)
- Андаманское море
- Сенсуализм
- «Сообразительный»
- Звёздная астрономия
- Балкано-кавказская раса
- Ямполь (пос. гор. типа в Донецкой обл.)
- Навигация (морск.)
- Кульчицкая Елена Львовна
- Мандельштама - Бриллюэна рассеяние
- Театральные учебные заведения
- Электрическая постоянная
- Энсор Джеймс